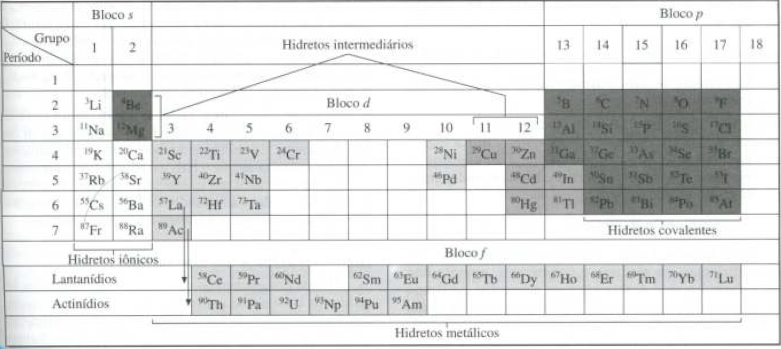
Os hidretos são compostos binários do
hidrogênio com outros elementos químicos, sendo o hidrogênio o mais eletronegativo
entre eles, sempre apresentando a carga -1 (H-1).
Fórmula
geral dos hidretos: XH.
Na constituição de um hidreto o
elemento químico que acompanha o hidrogênio pode ser de várias naturezas, porém
menos eletronegativo que o hidrogênio, como:
·
Metal (alcalinos e alcalinoterrosos);
·
Semimetal;
·
Ametal.
Representação na Tabela Periódica:
Imagem do livro “Química Inorgânica não tão concisa
– JD Lee”, pág. 127.
O tipo de hidreto formado depende da
eletronegatividade e do tipo de ligação do elemento, sendo possível
classifica-los em três classes:
Características:
Exemplos de hidretos iônicos:
2. Hidretos Covalentes ou Moleculares: são hidretos que apresentam
semimetais, ametais e metais que não são das famílias 1A, 2A e de transição.
Fórmula dos hidretos
covalentes: XH(18-n) (n é o numero do grupo da tabela ao qual o
elemento X pertence).
Características:
A tabela a seguir mostra alguns hidretos covalentes e seus
respectivos pontos de fusão e ebulição:
3. Hidretos Metálicos ou
Intersticiais: são hidretos que apresentam metais de transição,
elementos das séries dos lantanídeos e dos actinídeos.
Características:
Exemplos de hidretos metálicos:
Esses hidretos têm propriedades
similares e são menos densos que os metais correspondentes. A menor densidade
se deve à expansão do retículo cristalino pela inclusão do hidrogênio. O hidreto
pode se tornar quebradiço pela deformação que o retículo sofre.
DESAFIO: Em uma parte da tabela periódica, denominada “lacuna de hidrogênio”, há a ausência de hidretos. Qual é essa região? Responda nos comentários.
DESAFIO: Em uma parte da tabela periódica, denominada “lacuna de hidrogênio”, há a ausência de hidretos. Qual é essa região? Responda nos comentários.
Referências:
LEE, J.D. Química Inorgânica não tão Concisa. 5ª ed. São Paulo: Edgard Blücher Ltda., 1999. p. 126-129.